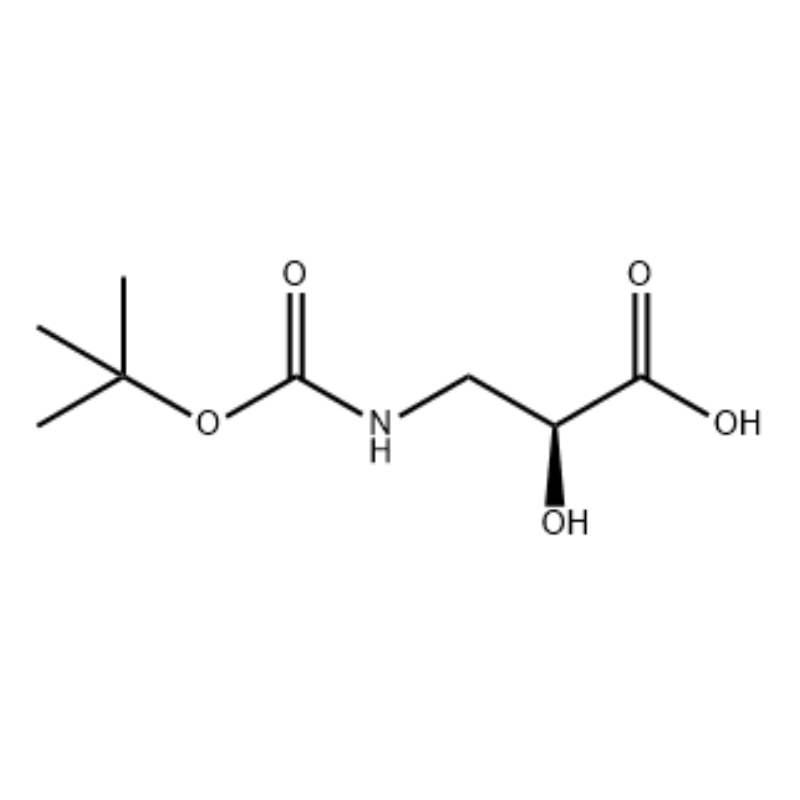
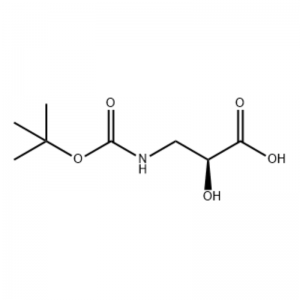
(S)-izoserino 15a (21 g, 0,20 mol) estis solvita en tetrahidrofurano (100 mL) Kaj miksita solvilo de 10 elcenta akva natria hidroksida solvaĵo (100 mL), Di-tert-butildikarbonato (50 mL, 0,22 mol) estis aldonis gute.La reago estis efektivigita ĉe ĉambra temperaturo dum 9 horoj.La akva fazo estis ĝustigita al pH 2 kun 4 mol/L klorida acido, kaj ĉerpita per diklormetano/metanolo (v/v = 5/1, 50 mL × 3). ) kaj sekigita super anhidra natria sulfato.Filtrilo per suĉo, koncentriĝi sub reduktita premo,La titola kunmetaĵo 15b estis akirita kiel senkolora oleo (35 g, rendimento: 85 elcentoj).
Al mova solvo de S-izoserino (4,0 g, 0,038 mol) en dioksano: H2O (100 ml, 1:1 v/v) je 0° C estis aldonita N-metilmorfolino (4,77 ml, 0,043 mol), sekvita de BoC2O (11.28 mL, 0.049 mol) kaj la reago estis movita dum la nokto kun laŭgrada varmiĝo al ĉambra temperaturo.Glicino (1,0 g, 0,013 mol) tiam estis aldonita kaj la reago estis movita dum 20 min.La reago estis malvarmetigita al O0C kaj sidis akv.NaHCO3 (75 ml) estis aldonita.La akva tavolo estis lavita per etilacetato (2 x 60 mL) kaj tiam acidigita al pH 1 kun NaHSO4.Ĉi tiu solvaĵo tiam estis ĉerpita kun etilacetato (3 x 70 mL) kaj ĉi tiuj kombinitaj organikaj tavoloj estis sekigitaj super Na2SO4, filtritaj kaj koncentritaj ĝis sekeco por doni la deziratan N-Boc-3-ammo-2(S)-hidroksi-propanoikan acidon. (6.30 g, 0.031 mmol, 81.5-procenta rendimento): 1H NMR (400 MHz, CDC13) δ 7.45 (bs, 1 H), 5.28 (bs, 1 H), 4.26 (m, 1 H), 3.40-3.62 (m) , 2 H), 2,09 (s, 1 H), 1,42 (s, 9 H);13C NMR (IOO MHz, CDC13) δ 174.72, 158.17, 82, 71.85, 44.28, 28.45.
N-Boc-3-amino-2(S)-hidroksi-propiona acido ;Al mova solvaĵo de S-izoserino (4,0 g, 0,038 mol) en dioksano: H2O (100 mL, 1:1 v/v) je 0° C estis aldonita N-metilmorfolino (4,77 mL, 0,043 mol), sekvita de BoC2O (11.28 mL, 0.049 mol) kaj la reago estis movita dum la nokto kun laŭgrada varmiĝo al ĉambra temperaturo.Glicino (1,0 g, 0,013 mol) tiam estis aldonita kaj la reago estis movita dum 20 min.La reago estis malvarmigita al 0 °C kaj sidis akv.NaHCO3 (75 ml) estis aldonita.La akva tavolo estis lavita per etilacetato (2 x 60 mL) kaj tiam acidigita al pH 1 kun NaHSO4.Ĉi tiu solvo estis tiam ĉerpita kun etilacetato (3 x 70 mL) kaj ĉi tiuj kombinitaj organikaj tavoloj estis sekigitaj super Na2SO4, filtritaj kaj koncentritaj ĝis sekeco por doni la deziratan N-Boc-3-amino-2(5)-hidroksi-propanoikan acidon. (6.30 g, 0.031 mmol, 81.5-procenta rendimento): 1H NMR (400 MHz, CDC13) δ 7.45 (bs, 1 H), 5.28 (bs, 1 H), 4.26 (m, 1 H), 3.40-3.62 (m) , 2 H), 2,09 (s, 1 H), 1,42 (s, 9 H);13C NMR (100 MHz, CDC13) δ 174.72, 158.17, 82, 71.85, 44.28, 28.45.
 Konstruaĵo 12, No.309, Suda 2-a Vojo, Ekonomia Disvolva Zono, Distrikto Longquanyi, Ĉengduo, Siĉuano, Ĉinio.
Konstruaĵo 12, No.309, Suda 2-a Vojo, Ekonomia Disvolva Zono, Distrikto Longquanyi, Ĉengduo, Siĉuano, Ĉinio. amy@enlaibio.com / cynthia@enlaibio.com / edison@enlaibio.com / daisy@enlaibio.com
amy@enlaibio.com / cynthia@enlaibio.com / edison@enlaibio.com / daisy@enlaibio.com +86 (028) 84841969
+86 (028) 84841969 +86 135 5885 5404
+86 135 5885 5404











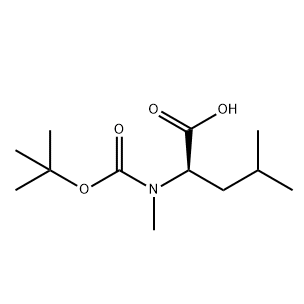






.png)


